RENCANA PELAKSANAAN PEMBELAJARAN
Nama
Sekolah :
SMA / MA ........
Mata
Pelajaran :
Kimia
Kelas /
Semester : XI
IPA / 1
Standard
Kompetensi :
3. Memahami
kinetika reaksi, kesetimbangan kimia, dan faktor-faktor yang mempengaruhinya,
serta penerapannya dalam kehidupan sehari-hari dan industri.
Kompetensi
Dasar :
3.2 Memahami
teori tumbukan (tabrakan) untuk menjelaskan faktor-faktor penentu laju dan orde
reaksi, dan terapannya dalam kehidupannya sehari-hari
Indikator
Pencapaian Kompetensi:
1. Membuat dan menafsirkan grafik dari
data percobaan tentang faktor-faktor yang mempengaruhi laju reaksi
2. Menjelaskan secara teoritis tentang
laju reaksi berdasarkan teori tumbukan
3. Menjelaskan pengertian dan peranan
katalis dan energi pengaktifan dengan menggunakan diagram, serta penggunaan
katalis dalam industri kimia.
Tujuan:
Siswa dapat,
1. Membuat dan menafsirkan grafik dari
data percobaan tentang faktor-faktor yang mempengaruhi laju reaksi
2. Menjelaskan secara teoritis tentang
laju reaksi berdasarkan teori tumbukan
3. Menjelaskan pengertian dan peranan
katalis dan energi pengaktifan dengan menggunakan diagram, serta penggunaan
katalis dalam industri kimia.
· Karakter siswa yang diharapkan:
Jujur, Kerja
keras, Toleransi, Rasa ingin tahu, Komunikatif, Menghargai prestasi, Tanggung
jawab, Peduli lingkungan
· Kewirausahaan / Ekonomi kreatif:
Percaya diri,
berorientasi tugas dan hasil
Materi Ajar
° Persamaan reaksi kimia
m A + n B à p C + q D
Persamaan laju reaksi kimia:
v = k [A]m [B]n
dimana, k : tetapan laju reaksi
m
: reaksi orde A
n
: reaksi orde B
Reaksi Orde
Orde
reaksi menyatakan besarnya pangkat konsentrasi pereaksi pada laju reaksi.
Jenis-jenis orde reaksi:
- Reaksi orde nol
- Reaksi orde satu
- Reaksi orde dua
Laju reaksi tidak dipengaruhi oleh besarnya konsentrasi pereaksi. Persamaan
laju reaksinya ditulis:
Bilangan dipangkatkan
nol sama dengan satu sehingga persamaan laju reaksi menjadi: r » k. Jadi,
reaksi dengan laju tetap mempunyai orde reaksi nol. Grafiknya digambarkan
seperti Grafik diatas.
2. Grafik Orde Satu
V = k [A]1 = k [A]
Reaksi orde satu ditunjukkan oleh grafik antara [A] dengan v yang merupakan garis linear.
Hubungan
kecepatan dengan konsentrasi
Persamaan reaksi orde
satu merupakan persamaan linier berarti laju reaksi berbanding lurus terhadap
konsentrasinya pereaksinya. Jika konsentrasi pereaksinya dinaikkan misalnya 4
kali, maka laju reaksi akan menjadi 41 atau 4 kali lebih
besar.
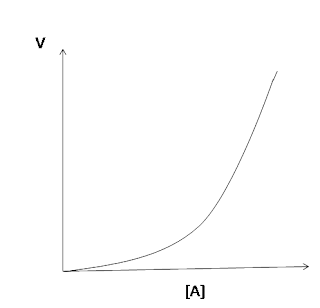
- 3. Grafik Orde Dua
Persamaan laju reaksinya :
v = k [A]2
Reaksi orde dua ditunjukkan oleh
grafik antara [A] dengan v yang merupakan Garis lengkung (parabola).
v = k [A]2
Reaksi orde dua ditunjukkan oleh
grafik antara [A] dengan v yang merupakan Garis lengkung (parabola).
Apabila suatu reaksi berorde
dua terhadap suatu pereaksi berarti laju reaksi itu berubah secara kuadrat
terhadap perubahan konsentrasinya. Apabila konsentrasi zat A dinaikkan misalnya
2 kali, maka laju reaksi akan menjadi 22 atau 4 kali lebih
besar.
Metode Pembelajaran:
° Pertemuan Pertama: 2 jam pelajaran (2 x 45 menit)
Metode Pembelajaran Ekspositori
° Pertemuan Kedua: 2 jam pelajaran (2 x 45 menit)
Model
Pembelajaran praktikum
° Pertemuan Ketiga: 2 jam pelajaran ( 2 x 45
menit)
Ulangan Harian
6 jam pelajaran (6 x 45 menit)
Strategi
Pembelajaran
Tatap Muka :
- Menjelaskan persamaan laju reaksi
- Menjelaskan cara menentukan persamaan laju reaksi
- Menjelaskan jenis-jenis orde reaksi dan pengeriannya
- Menyebutkan jenis-jenis orde reaksi dan pengertiannya
- Menentukan orde reaksi berdasarkan data percobaan
- Siswa dapat menyebutkan dan menjelaskan orde reaksi
- Siswa dapat menentukan orde reaksi berdasarkan data percobaan
- Siswa dapat membuat persamaan laju reaksi
Materi Ajar:
o Persamaan laju reaksi
o Orde Reaksi
Model
Pembelajaran Ekspositori
No
|
Kegiatan kelas
|
Alokasi waktu
|
Keterangan
|
A.
|
Kegiatan awal
|
10 menit
|
|
Salam pembuka
|
Religius
|
||
Memeriksa
kehadiran siswa
|
Senang
|
||
a. Apersepsi
Menanyakan tentang peristiwa alam
yang berlangsung cepat, sedang, dan lambat, serta faktor apa saja yang
mempengaruhinya, sebagai upaya menghubungkan konteks dengan konten
|
Rasa ingin tahu
|
||
b. Orientasi
Guru
menyampaikan tujuan pembelajaran yaitu siswa dapat menentukan orde reaksi dan
persamaan laju reaksi
|
Disiplin
|
||
c. Motivasi
Memotivasi
siswa tentang materi dan menyampaikan manfaat dari materi tentang orde dan persamaan
laju reaksi kedepannya
|
kreatif dan Rasa ingin tahu
|
||
B.
|
Kegiatan Inti
|
||
Eksplorasi
Guru
memberikan penjelasan tentang persamaan laju reaksi, orde satu, dua, dan tiga
serta aplikasi laju reaksi dalam kehidupan sehari-hari dan industri (Lampiran 2.3)
|
70 menit
|
Rasa ingin tahu
Kerja keras
|
|
Elaborasi
Guru
memberikan soal tentang menentukan persamaan laju reaksi kepada siswa (Lampiran
3.5)
|
Tanggung jawab
Percaya diri
|
||
Siswa
mendiskusikan jawaban soal dengan teman.
|
Kreatif, percaya diri, toleransi, dan
tanggung jawab
|
||
Salah satu
siswa mempresentasikan jawaban dari soal.
|
Rasa ingin tahu, toleransi, dan komunikatif
|
||
Konfirmasi
Guru
mengevaluasi jawaban dari siswa (lampiran 4.5)
|
Rasa ingin tahu
|
||
C.
|
Kegiatan
Akhir
|
10 menit
|
|
a. Guru bersama dengan siswa
membuat kesimpulan tentang materi yang dipelajari (penentuan orde, persamaan
laju reaksi, serta aplikasi laju reaksi)
|
Kreatif
Komunikatif
Kerja keras
|
||
b. Guru menyampaikan
materi untuk pertemuan berikutnya yaitu tentang teori tumbukan dan aplikasi
laju reaksi
Guru
memberikan tugas untuk mempelajari faktor yang mempengaruhi laju reaksi
|
Rasa ingin tahu
|
||
c. Salam penutup
|
Gembira
|
Pertemuan
Kedua: 2 jam pelajaran (2 x 45menit)
Materi Ajar:
o Faktor-faktor laju reaksi
o Aplikasi laju reaksi dalam kehidupan
sehari-hari dan industri
Model
Pembelajaran Praktikum
No
|
Kegiatan kelas
|
Alokasi waktu
|
Keterangan
|
A.
|
Kegiatan awal
|
10
menit
|
|
Salam pembuka
|
Religius
|
||
Memeriksa
kehadiran siswa
|
Senang
|
||
§ Apersepsi
Faktor apa
saja yang mempengaruhi laju reaksi? (Lampiran 1.3)
§ Orientasi
Guru
menyampaikan tujuan dari praktikum ini yaitu siswa dapat mengidentifikasi
faktor-faktor laju reaksi
§ Motivasi
Guru
menyampaikan manfaat dari mempelajari faktor-faktor laju reaksi kedepannya
|
Kerja
keras danRasa
ingin tahu
|
||
B.
|
Kegiatan Inti
|
||
Eksplorasi
o Memberikan pengarahan umum tentang
tata tertib melakukan percobaan yang efektif, efisien, dan memenuhi criteria
keselamatan kerja
o Guru membimbing siswa untukberkumpul dengan kelompoknya dan mempersiapkan alat/bahan,
serta melakukan percobaan sesuai denganmodul yang telah didistribusikan(Lampiran 2.4)
|
60
menit
|
Rasa ingin tahu,
Kerja keras,
kompak
|
|
Elaborasi
o Siswa melakukan percobaan
o Siswa mengamati gejala, mencatat
hasil pengamatan, melakukan interpretasi data, mendiskusikan fenomena, dan
menyimpulkan hasil percobaan
|
15
menit
|
Teliti,
tanggung jawab, kertja keras
|
|
Konfirmasi
o Membimbing siswa untuk membuat laporan sementara
|
5
menit
|
Kerja keras, dan tanggung jawab
|
|
C.
|
Kegiatan
Akhir
|
||
b. Guru memberikan tugas
kepada siswa untuk membuat laporan resmi serta memberi tahukan format laporan
resmi
|
10
menit
|
Komunikatif
Kerja keras
|
|
c. Guru menyampaikan tanggal pengumpulan
laporan
|
Toleransi
|
||
d. Salam penutup
|
Gembira
|
Pertemuan Ketiga: 2 jam pelajaran (2 x 45 menit)
Materi Ajar:
Ulangan Harian
Kegiatan Awal : (5 menit)
- Salam Pembuka (Religius)
- Memeriksa kehadiran siswa (Senang)
- Menyuruh siswa untuk mengumpulkan catatan (Kerja keras dan toleransi)
- Membagikan soal ulangan harian serta lembar jawab kepada siswa (Toleransi)
- Siswa mengerjakan ulangan harian (Rasa ingin tahu)
- Guru memeriksa catatan siswa (Toleransi)
- Guru mengambil lembar jawab (Toleransi)
- Guru menghitung lembar jawab (Kerja keras)
- Salam penutup (Gembira)
Alat / Bahan /
Sumber Belajar:
· Alat :
LCD
Komputer
Papan tulis
Spidol
Penghapus
Jas Praktikum
Peralatan praktikum laju reaksi
Bahan praktikum laju reaksi
· Bahan
: Modul praktikum laju reaksi
Buku Kimia 2 untuk SMA
LKS Kimia Kelas XI SIMPATI Semester 1
· Sumber
: Purba, Michael. 2004. Kimia Kelas XI. Jakarta.Erlangga
Buku Kimia 2 untuk SMA
LKS Kimia Kelas XI SIMPATI Semester 1


Tidak ada komentar:
Posting Komentar